エプソムソルトの成分・化学的背景
エプソムソルトの成分・化学的背景
「硫酸マグネシウム」、通称「エプソムソルト(Epsom Salt)」は、ただの「お湯に入れる塩」ではなく、化学的にも興味深いミネラル結晶です。ここでは、その成分や科学的なしくみについて整理します。
化学式と構造:MgSO₄の世界
エプソムソルトの主成分は「硫酸マグネシウム(MgSO₄)」です。
水和結晶として「七水和物(MgSO₄・7H₂O)」が最も一般的で、これが “Epsom Salt” として流通している形態です。
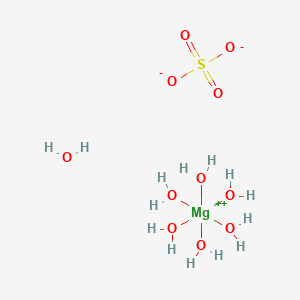
化学的には、マグネシウムイオン(Mg²⁺)と硫酸イオン(SO₄²⁻)がイオン結合してできた塩で、水と一緒に結晶化すると水和物になります。
水和物(hydrate)であることで、結晶形や融点・溶解度に特徴が出ており、入浴剤として使われる際の“溶けやすさ”にも関係しています。
物理・化学的特性:溶解性と水和結晶
硫酸マグネシウムは白色の結晶性固体で、水にかなり溶けやすい性質があります。
例えば、ある資料では「水0 °Cで269 g/L」という高い溶解度が報告されています。
また、水和結晶としては七水和物(MgSO₄·7H₂O)のほか、六水和物・モノ水和物など複数の水和状態が自然界や工業的にも確認されています。
さらに、加熱すると水和物が脱水・分解する特性もあります。たとえば、無水化した MgSO₄ は 1124 °C で分解するというデータもあります。
このような化学的・熱的挙動が、「浴剤として使われる際の溶けやすさ」や「結晶構造の変化」といった背景を支えています。
なぜ入浴剤に?:マグネシウムと硫酸イオンの働き
エプソムソルトが入浴剤として用いられる背景には、溶け出すと湯中にマグネシウムイオン(Mg²⁺)と硫酸イオン(SO₄²⁻)が生成される点があります。
マグネシウムは身体にとって必須ミネラルで、筋肉・神経の機能維持、代謝、酵素反応などに関与しています。硫酸イオンもまた体内外の反応・水分バランスに影響を持つと考えられています。

ただし、入浴中にどれだけのマグネシウム・硫酸イオンが皮膚を通して吸収されるか、という点については「十分な科学的裏付けがない」という指摘もあります。
つまり、化学的には “溶けてイオン化する” という仕組みは明らかですが、それが体内への実質的な吸収・効果に結びついているかどうかは、まだ議論があるということです。
構造・起源:ミネラルとしての面も
実はこの硫酸マグネシウム七水和物(MgSO₄·7H₂O)はミネラル名として「エプソマイト(Epsomite)」とも呼ばれており、鉱物学的にも存在します。
このことから、「バスソルト」という日常用途だけでなく、地質・鉱物学的にも興味深い化合物であることがわかります。
また、MgSO₄ の水和物は温度・圧力条件により様々な形(六水和、モノ水和など)を取り、自然界では湖底・蒸発塩層・地下水の析出物としても見られます。
まとめ:成分を知ることで入浴が深まる
・化学式:MgSO₄(硫酸マグネシウム)
・最も一般的な形:MgSO₄·7H₂O(七水和物)
・主な構成イオン:Mg²⁺(マグネシウム)+ SO₄²⁻(硫酸イオン)
・特徴的な性質:高い水への溶解性・水和結晶の変化・加熱分解特性
このように、エプソムソルトは「ただの塩」ではなく、化学的・物理的に興味深い結晶ミネラルです。入浴剤として日々使う際に、成分の背景を知っておくと「なぜ湯に溶けるのか」「どう体に関わる可能性があるのか」が理解できます。
次回の記事では、実際に「効用・活用メカニズム」について海外論文・レビューをもとに深掘りしていきますので、ぜひご期待ください。
※ 本記事は海外の化学資料・鉱物学データを参考に構成しています。入浴による効果には個人差があり、医学的・治療的用途には専門医の判断を仰いでください。